 La semana pasada comenzamos ha explicar de forma sencilla los conceptos físicos de la termodinámica, tratando de que sea de fácil comprensión para cualquier persona. Hoy insistimos en los mismos conceptos.
La semana pasada comenzamos ha explicar de forma sencilla los conceptos físicos de la termodinámica, tratando de que sea de fácil comprensión para cualquier persona. Hoy insistimos en los mismos conceptos.
Un cuerpo, o un conjunto de cuerpos, que podamos estudiar aisladamente (que podría ser, por ejemplo, un frigorífico o una vivienda, con todo los elementos que contienen en su interior) conforman un Sistema. Que como ya vimos, el sistema podrá ser abierto o cerrado.
Ese sistema no contiene «calor», lo que contiene es energía (que puede ser cinética, química, potencial gravitacional, potencial elástica, nuclear). En el interior del sistema conviven distintos tipos de energía, asociadas a las partículas microscópicas que los componen y que forman su energía interna (U). En función de la cantidad de energía cinética, esto es del movimiento que tengan las partículas que componen los cuerpos de ese sistema, podremos medir una temperatura mayor o menor.
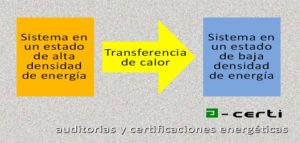
Si junto a este sistema hay otro con menor densidad de energía se va a producir una transferencia de calor desde el sistema 1 (con alta temperatura) hacia el sistema 2 (con baja temperatura). El calor es energía en tránsito. El segundo sistema tampoco contendrá «calor» sino energía.
La primera ley de la termodinámica, también conocida como principio de conservación de la energía para la termodinámica, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará.
La ecuación general de la conservación de la energía es la siguiente:
E entra – E sale = ΔE sistema
Que aplicada a la termodinámica teniendo en cuenta el criterio de signos termodinámico, queda de la forma:
ΔU= Q – W ,siendo:
U= Energía Interna del sistema
Q= Calor que ingresa al sistema
W= Trabajo realizado por el Sistema
La primera ley de la termodinámica da una definición precisa del calor, y lo identifica como una forma de energía. Puede convertirse en trabajo mecánico y almacenarse, pero no es una sustancia material.
La segunda Ley de la termodinámica afirma que la energía tiene calidad, además de cantidad, y los procesos reales se producen solamente en una dirección. Se pasa de un estado de energía de más calidad a menor calidad.
Por ejemplo, una taza de café caliente sobre la mesa en algún momento se enfriará, pero si dejamos sobre la misma mesa una taza de café frío nunca se calentará por si misma de forma espontánea. A esto se denomina proceso irreversible y significa que necesitaremos realizar un trabajo efectivo, para volver a calentar ese café y que una parte de la energía que empleemos no podrá transformarse en un trabajo útil, aumentando la entropía del sistema.
Si en vez de una taza de café pensamos en un vivienda en la que queremos conservar el calor, por mucho que la aislemos será un sistema abierto que intercambiará materia (ventilación) y energía (calor) con el exterior, por lo que si no tenemos ningún sistema de calefacción (ganancias térmicas) terminará, de forma irremediable, a la misma temperatura que su entorno.
A pesar de lo dicho, si aumentamos el aislamiento y la hermeticidad de esa vivienda, su intercambio de calor se minimizará y si además aprovechamos las ganancias internas o las externas gratuitas (radiación solar en nuestras ventanas) también se minimizará la cantidad de energía que necesitaremos para alcanzar el equilibrio entre las ganancias y las perdidas de ese sistema.
Si queréis repasar conocimientos sobre las leyes de la termodinámica o sobre los conceptos físicos elementales, aquí los encontrareis explicados de una forma sencilla. La próxima semana hablaremos de cómo se produce la transferencia de calor entre esos dos sistemas, no os lo perdáis.



